Il y a actuellement  visiteur(s) sur le site.
visiteur(s) sur le site.
|
Il y a actuellement
|
 |
 |
|
Ce corps simple, est un 'non-métal' très répandu dans la nature. Il est également présent dans le corps humain
Il est connu et utilisé depuis la plus haute antiquité. Il était nommé sulvere en sanskrit, suelphlos en indo-européen et sulpur ou sulphus en latin. Son symbole chimique est S, sa masse atomique est 32,06 g. Il a un point de fusion de 115,2° C, et son point d'ébullition est de 444,7° C. Il se présente sous plusieurs formes allotropiques, (ce qui signifie que sous ces formes il présente des propriétés physiques différentes). Par exemple, au dessous de 98° C, on le nomme soufre A, il est orthorhombique et sa densité est de 2,07, au dessus de 98° on le nomme soufre B, il est monoclinique et sa densité est seulement de 1,96. Un refroidissement rapide produit un soufre amorphe et plastique. Dans la nature, il est présent à l'état natif, nous en parlerons ci-après. Mais il est surtout la base de nombreux minéraux, les sulfures des métaux, (sauf l'or), la pyrite de fer ou de cuivre (la chalcopyrite), la stibine, la galène, le cinabre, la blende ... les sulfates, le gypse par exemple. On trouve également le soufre à l'état libre dans les eaux minérales chaudes et il accompagne le pétrole et le gaz, d'où on le retire, ce qui représente une part non négligeable de la production mondiale, (soufre de Lacq en France). Il est produit en abondance par les volcans et les solfatares, celle de Naples produit des vapeurs de sulfure d'antimoine et de minuscules cheminées de soufre cristallisé. Le soufre a de nombreux usages, il est utilisé pour produire l'acide sulfurique, (les alchimistes produisent facilement cet acide à partir des pyrites de fer), il est utilisé pour vulcaniser le caoutchouc, pour faire les allumettes, de la poudre à canon, des médicaments, des insecticides etc. Pour en venir à l'objet de cet article, les alchimistes utilisent des produits 'natifs' c'est-à-dire n'ayant pas été 'dérangés' depuis des millénaires. Pour le soufre cette philosophie exclue le soufre récemment (à l'échelle des temps géologiques) produit par les volcans et à plus forte raison par l'industrie. Seul le soufre natif, présent dans les dépôts accumulés à froid par les phénomènes hydrogéologiques répond à ces critères. Ce soufre, cité sous le nom de soufre de carottage, (quand il provient des carottes prélevées à divers endroits pour déterminer l'étendue et la richesse d'une mine de soufre), est bien entendu le même que celui de la mine quand elle est mise en exploitation. Formant des gisements à teneur très variables, le soufre natif se trouve dans les anciennes régions volcaniques. Son minerai est un mélange de terres marneuses, de calcaire, de gypse et parfois de bitume. On trouve des gisements au Mexique, aux USA, au Japon, en Italie et en plus faible quantité dans d'autres régions. En ce qui concerne la France on peut en trouver de façon marginale dans les Bouches du Rhône (Camoins), à Malvezy-Narbonne dans l'Aude et à Apt dans le Vaucluse. Il faut que ce soufre soit brut d'exploitation et n'ait pas été fondu. En possession de son soufre, l'alchimiste se doit par la suite de ne le purifier qu'à basse température. Pour cela, seule une opération de dissolution-cristallisation par solvant est envisageable. Seulement quatre solvants sont possibles hors moyens industriels. Les trois premiers, le disulfure de carbone CS2 qui permet de dissoudre 50 g. de soufre par litre, le dioxyde de soufre O2S et le benzène, (produits réservés aux installations industrielles) sont toxiques et facilement inflammables, nous refusons d'en parler pour des raisons de sécurité incendie. Le quatrième, tout aussi toxique mais moins volatil est ininflammable. C'est le tétrachlorure de carbone CCl4 et c'est à notre avis la seule voie. Nous prévenons que les manipulations qui suivent ne doivent être entreprises que par des pratiquants conscients des précautions à prendre et ayant l'habitude de manipuler. Pour ce solvant, et pour relativiser les risques, il faut disposer d'un masque à gaz avec cartouche pour solvants volatils. Ce solvant qui était autrefois en vente libre est maintenant assez difficile à se procurer. Il présente pour nous l'énorme avantage d'entrer en ébullition dès 77° C et peut même aussi être congelé à - 23° C. Il produit à l'état gazeux une vapeur lourde, idéale pour l'utilisation du réfrigérant à reflux surmontant le soxhlet. En pratique : On commence par placer au fond du corps du soxhlet une rondelle de coton à démaquiller, découpée en ménageant une partie en pointe, qui se logera dans l'amorce du tube du siphon de façon à interdire aux éventuelles particules de soufre cristallisé de s'y introduire. On chargera la cartouche avec son soufre, sans trop la remplir pour que du soufre ne risque pas de passer entre cartouche et corps du soxhlet. Au cas où la cartouche serait avec fond en verre frité, placer une rondelle de coton au fond pour la protéger. Toutes ces précautions, pour ne pas avoir à nettoyer des traces de soufre, insolubles dans le liquide vaisselle ! Deuxième opération, mettre au fond du ballon quelques perles de céramique, ou tout simplement des perles en verre de collier pour réduire les bulles dues à la caléfaction, (la pierre ponce ne convient pas pour un liquide de cette densité). Troisièmement, assembler le tout et mettre en marche la réfrigération. Quatrièmement, introduire lentement, par le haut du réfrigérant une quantité de tétrachlorure de carbone telle qu'il en restera un peu moins de 1/3 de la capacité du ballon au moment où le corps du soxhlet sera au point haut de son remplissage. Ceci est important et peut faire préalablement l'objet d'un essai avec de l'eau, le but est qu'il reste toujours du liquide pour noyer le soufre extrait et que le ballon soit le moins rempli possible, car au moment du vidage par le siphon il se produit une émulsion qui doit impérativement rester localisée dans le ballon. Cinquièmement, déposer en haut du soxhlet un bouchon posé à l'envers, (Voir image, surtout ne pas boucher) et destiné à éviter qu'un courant d'air aspire et répande de la vapeur de solvant dans le labo. Ensuite mettre en chauffe progressive. Si ces précautions sont prises, vous pouvez quitter masque et gants, il n'y aura pas la moindre odeur, il suffit de surveiller que le réfrigérant reste froid dans sa moitié supérieure. Il ne faut pas être pressé, (un alchimiste ne doit jamais l'être) car l'action de ce solvant est lente, mais on est récompensé par la vue du très beau soufre qui se dépose en microcristaux au fond du ballon. Une fois la cartouche épuisée, après s'être rééquipé, on la renouvelle ou si l'on termine, il faut récupérer par filtrage le solvant. Pour cela, on place un filtre (qui ne dépasse pas les bords) dans un entonnoir en verre. L'entonnoir est placé sur un flacon avec rodage, dont le bouchon est préalablement enduit de graisse silicone. On se sera muni d'une plaque de verre destinée à couvrir l'entonnoir, partiellement lors du vidage du ballon, totalement à la fin de l'opération effectuée sans précipitation ni éclaboussure. On laisse bien égoutter et on ferme soigneusement le flacon. Pour son utilisation ultérieure, on prendra soin de priver totalement le soufre purifié des traces de tétrachlorure qui le polluent (odeur facilement décelable), pour cela, on le chauffera très lentement au bain marie en condensant les vapeurs de solvant dans un ballon réfrigéré (glace salée par exemple). Ce solvant classé 'dangereux pour l'environnement' est heureusement récupérable à plus de 98 % et réutilisable. La seule nuisance est l'évaporation en extérieur des traces de solvant qui mouillent encore le soufre filtré et égoutté. La récolte de la matière première. |
 |
 |
 |
 |
 |
 |
|
Avant, après.
|
 |
 |
|
La purification de la matière première au soxhlet.
|
 |
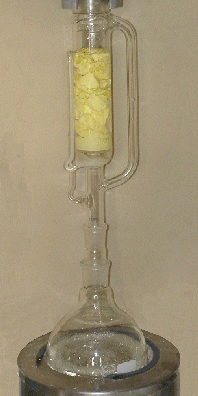 |
 |
|
L'utilisation d'un produit dangereux,
(dans ce cas bien moins qu'un acide) nous pose un certain problème moral, devons-nous décrire un tel processus ou laisser un débutant livré à lui-même tâtonner ? Nous avons choisi de l'informer et de le mettre en garde. Nous pensons que seul le bris du contenant est dangereux, plus pour l'environnement que pour l'opérateur convenablement protégé, car il n'y a, dans ce cas, malheureusement rien à faire d'autre que de s'éloigner rapidement et laisser agir l'évaporation naturelle.
D'une manière générale, personne ne devrait manipuler un produit sans avoir lu sa fiche toxicologique facile à se procurer sur le web. |
|
VERS ARTICLES 2005
|