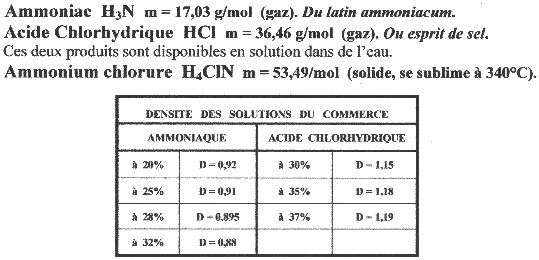
On peut, à partir du tableau ci-dessus et de la densité, optimiser les constituants.
Une remarque en passant : si la concentration ne figure pas sur l'emballage, il faut passer par la mesure de la densité. Les densimètres modernes sont établis pour la température de 20°C, ce n'est pas le cas des anciens que l'on trouve d'occasion (brocantes et dépôts-ventes) il faut donc s'assurer de ce point très important.
On utilise de l'eau de pluie filtrée soigneusement (les eaux minérales et dites déminéralisées contiennent toujours les minéraux en suspension et leur densité n'est pas de 1).
On met au frigo une grosse éprouvette d'eau, puis on la ressort quand elle est aux alentours de 10°C. on y plonge un thermomètre et le densimètre. On surveille la remontée en température en lisant la densité en dessous du ménisque. Généralement les anciens densimètres sont étalonnés pour 15°C. Si c'est le cas, les mesures devront être faites à cette température. Il existe des possibilités de correction, mais ne compliquons pas plus. J'ai toujours été étonnée que cette indication de température ne figure pas sur le densimètre, même moderne.
Utilisons les données disponibles :
Nous avons par exemple, de l'acide chlorhydrique à 35%, de densité 1,18.
Dans un litre il y a donc 35% d'acide gazeux dissous soit 413 g. et 65% d'eau soit 764 g.
Une mole d'acide ayant une masse de 36,46 g., dans un litre de solution on a donc 413/36,46 = 11,33 moles d'acide.
De même, supposons que nous ayons de l'ammoniaque à 20%, de densité 0,92.
Dans un litre il y a 20% de gaz ammoniac soit 184 g. et 736 g. d'eau.
Une mole d'ammoniac ayant une masse de 17,03 g., dans un litre de solution on a donc 184/17,03 = 10,80 moles d'ammoniac.
Une mole de sel ammoniac a une masse de 53,49 g. composée de une mole d'acide chlorhydrique et de une mole d'ammoniac.
il faut donc pour préparer une mole de sel ammoniac utiliser en volume de solutions :
1000 cc/11,33 soit 88,26 cc d'acide.
1000 cc/10,80 soit 92,60 cc d'ammoniaque.
Soit un total d'environ 180 cc de mélange, (il y a aussi des contractions de volume, donc ne cherchons pas la petite bête).
|